सेल (Cell)
यह एक स्थैतिक युक्ति है जो रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित करता है। इसे सर्किट में ऐसे दर्शाया जाता है-

ये दो प्रकार के होते हैं
(1) प्राथमिक सेल (Primary Cell)
. जिन सेलों में रसायनों के रासायनिक क्रियाओं के फलस्वरूप विद्युत वाहक बल विकसित होता है उन्हें
प्राथमिक सेल कहते हैं।
. इसमें रासायनिक क्रिया अनुत्क्रमणीय होता है।
. प्राथमिक सेल में पैदा होने वाले स्थानीय क्रिया दोष को जस्ता इलेक्ट्रोड पर पारे की पर्त चढाकर (Amalgamation) दूर किया जा सकता है।
. ये सेल निम्न प्रकार के होते हैं :
(i) वोल्टेइक सेल (Voltaic Cell).
. सर्वप्रथम वोल्टा नामक वैज्ञानिक ने रसायनिक क्रियाओं के द्वारा विद्युत वाहक बल पैदा कर इसे बनाया था।
. इसमें इलेक्ट्रोलाइट (Electrolyte) के रूप में तनु सल्फ्यूरिक अम्ल (H2SO4) तथा एनोड एवं कैथोड के रूप में क्रमश: जस्ता की छड़ एवं ताँबे की छड़ का प्रयोग किया जाता है।
. इसका विद्युत वाहक बल 1.08 volt होता है।

(II) डेनियल सेल (Daniel Cell)
. कैथोड के रूप में ताँबे का एक बेलनाकार पात्र प्रयोग किया जाता है। बर्तन में ऊपर की ओर ताँबे का छिद्रयुक्त छज्जा (Balcony) बना होता है जिसमें कॉपर सल्फेट (CuSO4) के ठोस रखे (Crystals) भरे जाते हैं।
. इसमें इलेक्ट्रोलाइट (Electrolyte) के रूप में कॉपर सल्फेट का घोल प्रयोग किया जाता है।
. एक लम्बे बेलनाकार संरध्र पात्र (Porous Pot) में तनु H2SO4 भरा जाता है और उसके बीच एक जस्ते की छड़ होती है जो एनोड का कार्य करती है।.
. डेनियल सेल का विद्युत वाहक बल (E.M.F) 1.1 वोल्ट होता है जो स्थिर होता है।
. इसका आंतरिक प्रतिरोध 2.6 ohm होता है।

(iii) लैकलांची सेल (Lechlanche Cell)
. इसमें इलेक्ट्रोलाइट के रूप में अमोनियम क्लोराइड (NH4CI) का घोल होता है।
. इसमें कार्बन की छड़ कैथोड का कार्य करती है तथा इलेक्ट्रोलाइट में डुबोई जस्ते की छड़ एनोड का कार्य करती है।
. इसमें विध्रुवक के रूप में मैंगनीज-डाई-ऑक्साइड (MnO2) रहता है।
. लैकलांची सेल का विद्युत वाहक बल 1.46 volts होता है।
. इसका आंतरिक प्रतिरोध 1-52 तक होता है।
. वोल्टेइक अथवा लैकलांची सेल में पॉजिटीव इलेक्ट्रॉड के चारों ओर हाइड्रोजन आयन्स का एकत्र होना ध्रुवाच्छादन कहलाता है।
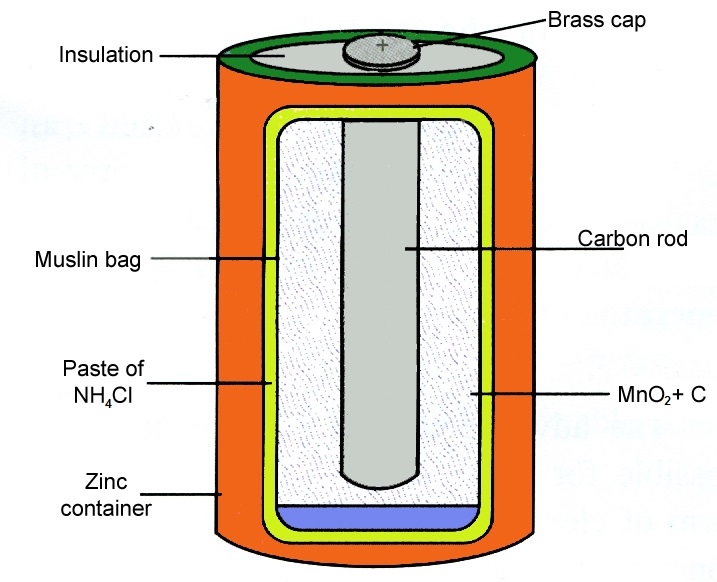
(iv) शुष्क सेल (Dry Cell)
. शुष्क सेल, लैकलांची सेल का ही संशोधित रूप है।
. इसमें जस्ते का एक बेलनाकार पात्र होता है जो एनोड का कार्य करता है।
. पात्र के ठीक मध्य में एक कार्बन की छड़ स्थापित की जाती है जो कैथोड का कार्य करती है।
. इसमें अमोनियम क्लोराइड, जिंक क्लोराइड तथा प्लास्टर ऑफ पेरिस की लुगदी (Paste) इलेक्ट्रोलाइट के रूप में भरी होती है।
. इसका विद्युत वाहक बल 1.4 --1.5 वोल्ट तक होता है।
. इसका उपयोग टॉर्च, दीवार घड़ी, विद्युत घण्टी इत्यादि उपकरणों में होता है। इसमें मैंगनीज-डाइ-ऑक्साइड मुख्य रूप से विध्रुवक होता है।
(v) मरकरी (Mercury Cell)
. इसमें स्टेनलेस स्टील का एक बेलनाकार पात्र होता है जिसकी तलो में मरक्यूरिक ऑक्साइड चूर्ण की (HgO) एक परत होती है जो विध्रुवक एवं कैथोड की भांति कार्य करती है।
. इसमें पोटैशियम हाइड्रॉक्साइड (KOH) की लुगदी जिंक ऑक्साइड (ZnO) के साथ इलेक्ट्रोलाइट के रूप में प्रयोग किया जाता है
. इलेक्ट्रोलाइट परत के ऊपर शुद्ध जस्ता चूर्ण का एनोड बनाया जाता है।
. इस सेल का विद्युत वाहक बल 1.35 से 1.4 वोल्ट तक का होता है।
. इसका व्यास 4 मिमी० तक तथा ऊंचाई 2.5 मिमी तक का होता है।
. इसे बटन सेल (Button Cell) भी कहते हैं।
. इसका उपयोग कलाई पड़ी, पॉकेट कैलकुलेटर आदि में होता है।

(vi) सिल्वर ऑक्साइड मेल (Silver Oxide Cell)
. इसकी संरचना भी मरकरी सेल की भाँति ही होती है लेकिन इसमें Hgo के स्थान पर सिल्वर ऑक्साइड (Ag2O) प्रयोग किया जाता है।
. इसका E.M.F 1.5 वोल्ट होता है।
. यह मरकरी सेल की अपेक्षा महँगा होता है परन्तु इसकी दक्षता उच्च होती है।
. इसका उपयोग अतिलघु आकार वाले डिजिटल उपकरणों में होता है।

(2) द्वितीयक सेल (Secondary Cell)
. इसे पहले विद्युत देकर आवेशित करना पड़ता है तब यह विद्युत वाहक बल उत्पन्न करता है। इसे पुनरावेशित किया जा सकता है।
. इसका विद्युत वाहक बल अधिक होता है। इसमें रासायनिक क्रिया उत्क्रमणीय होती है।
. इसे संचित सेल भी कहा जाता है।
(i) लैड ऐसिड सेल (lead acid cell)

इसके प्रमुख भाग निम्नलिखित हैं
(a) धन प्लेट (Positive Plate)
यह लेड परऑक्साइड (PbO2) का बना होता है। यह कैथोड होता है। पूर्ण चार्ज की अवस्था में यह गहरे भूरे (चॉकलेटी) रंग का होता है।
(b) ॠण प्लेट (Negative Plate)
यह स्पंजी सीसा (Pb) का बना होता है।
पूर्ण चार्ज की अवस्था में यह स्लेटी (grey) रंग का होता है।
(c) वैद्युत अपघद्य (Electrolyte)
. लँड एसिड सैल में इलेक्ट्रोलाइट के रूप में तनु सल्फ्यूरिक अम्ल (Dilute Sulphuric Acid) H2SO4 प्रयोग किया जाता है।
. इसमें जल और अम्ल का अनुपात क्रमश: 3:1 होता है।
. इलेक्ट्रोलाइट की अवस्था को आपेक्षिक घनत्व (Specific gravity) के रूप में व्यक्त किया जाता है।
. इलेक्ट्रोलाइट का आपेक्षिक घनत्व हाइड्रोमीटर से मापा जाता है।
. बैटरी के पूर्ण चार्ज होने पर इलेक्ट्रोलाइट की स्पेसिफिक ग्रेविटी 1.285 होती है।
. चार्ज लेड एसिड बैटरी का इलेक्ट्रोलाइट गाढ़ा होता है।
. यदि इलेक्ट्रोलाइट का आपेक्षिक घनत्व 1.285 से भी अधिक हो जाये तो प्लेटों के ग्रिड पर जंग लगने से इसकी क्षमता कम हो जायेगी और बैटरी का कार्यकाल कम हो जायेगा।
. इलेक्ट्रोलाइट में ही धन और ऋण प्लेटों को डुबोया रखा जाता है तथा इलेक्ट्रोलाइट का लेवल प्लेट के तल से 10-20mm ऊपर तक रखा
जाता है।
. अगर इलेक्ट्रोलाइट का स्तर प्लेटों से नीचे हो जाए तो उनकी क्षमता कम हो जायेगी।
. इलेक्ट्रोलाइट विद्युत के सुचालक होते हैं।
. स्टोरेज बैट्री का emf इलेक्ट्रोलाइट के प्रकार पर भी निर्भर करता है तथा प्लेट के क्षेत्रफल पर भी निर्भर करता है।
(d) सैपरेटर (Separator) :
. घन और ऋण प्लेटों को आपस में शार्ट-सर्किट होने से बचाने के लिए उनके बीच एक अचालक रखा जाता है जिसे सैपरेटर कहते हैं।
(e) कॉन्टेनर (Container)
. यह hard glass या hard rubber का बना होता है ताकि अम्लों में अभिक्रिया न करे।
. इसी के अंदर धन प्लेट, ऋण प्लेट, वैद्युत अपघट्य, सैपरेटर इत्यादि को व्यवस्थित किया जाता है।
(f) वेन्ट कैप (Vent Cap)
. यह बैटरी के ऊपर में बना हुआ छिद्र होता है जिससे कि अम्ल और पानी की हुई कमी को पूरा किया जाता है।
. चार्जिंग के वक्त इसे खोल दिया जाता है ताकि रासायनिक क्रियाओं द्वारा बनी गैसे इससे बाहर आ सके।
. इसमें धन प्लेटों की संख्या ऋण प्लेटों की संख्या से एक कम होती है।
. लेड ऐसिड सेल का प्रति सेल आंतरिक प्रतिरोग हमेशा एडीसन सेल से कम होता है।
. लेड एसिड सेल का औसत वि० वा० बल (E.M.E) 2.2 V होता है।
. यदि किसी लेड-एसिड बैट्री को लम्बे समय तक निष्क्रिय रखना हो, तो बैट्री का इलेक्ट्रोलाइट निकालकर इसके प्लेटों को सुखाकर शुष्क, ठंडे
एवं साफ जगह में सुरक्षित रखना चाहिए।
. लेड एसिड बैट्री में गैस बाहर निकालने के लिए फिल्टर लगाये जाते हैं।
. इस बैट्री के डिस्चार्ज के समय दोनों एनोड और कैथोड लेड सल्फेट (PbSO4) में परिवर्तित हो जाते हैं। लेड एसिड बैटरी की एम्पियर-घण्टे दक्षता 90-95% रहती है। इसका अनुमानित कार्यकाल दो से पाँच वर्ष है। जब ये बैट्री उपयोग में नहीं आ रही हो, तब भी बैटरी लगभग 6 दिन बाद अवश्य चार्ज करना चाहिए।डिस्चार्ज सेल के इलेक्ट्रोलाइट का आपेक्षिक घनत्व 1.14 होता है।
(ii) एडीसन सेल (Edison Cell)/ निकेल iron (Ni-Fe-Cell) :
. यह एक क्षारीय सेल है।
. इसमें एक स्टील के पात्र में निकेल आलेपित स्टील की बेलनाकार प्लेटें धन प्लेटो का कार्य करती है।
. इन प्लेटों में कुछ पॉकेट्स (Pockets) बनाकर उसमें आयरन हाइड्रेट (Fe(OH),) चूर्ण भरा जाता है जो एनोड (ॠण प्लेट) का कार्य करती है।
. इसमें इलेक्ट्रोलाइट के रूप में पोटेशियम हाइड्रॉक्साइड (KOH) तथा लिथियम हाइड्रेट (LIOH) का मिश्रण प्रयोग किया जाता है।
. इसका विद्युत वाहक बल 1.2-1.5 V तक होता है। यह एक तर सेकेंडरी सेल होता है।

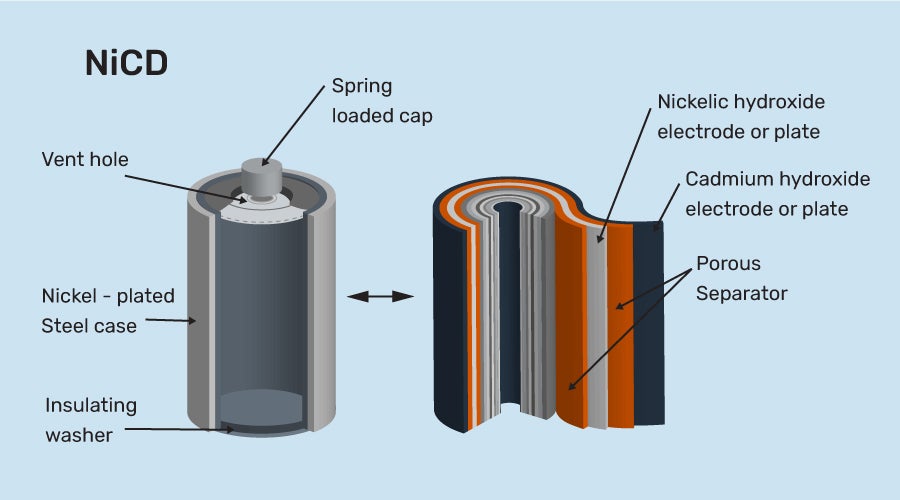
(iii) निकेल कैडमियम सेल (Nickel Cadmium Cell)
. यह भी एक क्षारीय सेल है।
. इसकी संरचना भी एडीसन सेल के समान ही होती है। अंतर सिर्फ यह होता है कि इसमें ऋण प्लेट के रूप में कैडमियम धातु प्रयोग होती है।
. कैड्मीअम धातु के प्रयोग से सेल का आंतरिक प्रतिरोध घाट जाता है




0 टिप्पणियाँ